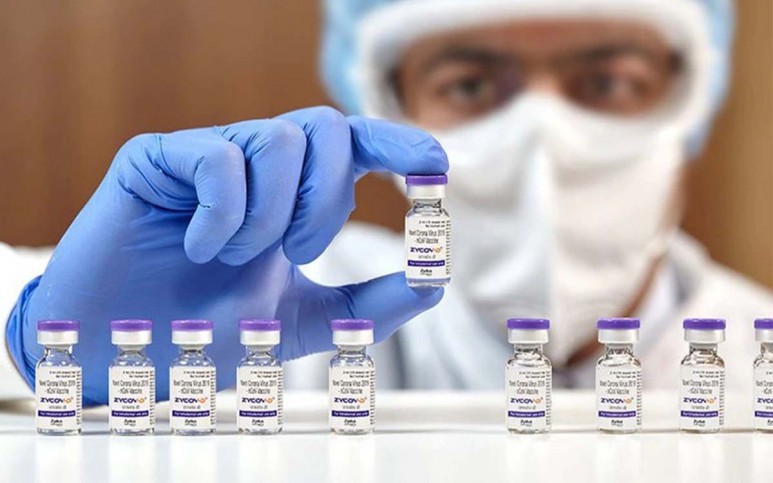
Covaxin: por qué la vacuna india podría ser clave en el combate contra la pandemia
Viernes 05 de
Noviembre 2021
La Organización Mundial de la Salud otorgó el miércoles 3 de noviembre la autorización para su uso de emergencia de la vacuna contra el COVID-19 Covaxin, fabricada en India con lo que sumó una nueva herramienta a la lucha contra el coronavirus que causó la actual pandemia.
Esto convirtió a ese inoculante en el octavo aprobado por el organismo internacional.
La vacuna es un desarrollo del laboratorio indio Bharat Biotech en sociedad con el Consejo de Investigación Médica de India, el organismo de investigación del gobierno de ese país. Se trata de la primera desarrollada y fabricada por el país asiático. Las otras vacunas que cuentan con la aprobación de la OMS son Pfizer-BioNTech, Moderna, Johnson & Johnson, Oxford/AstraZeneca (y su versión india, Covishield), Sinovac y Sinopharm.
Esta aprobación fue celebrada por el primer ministro indio, Narendra Modi, quien enfatizó su intención de hacer que su país sea autosuficiente en la lucha contra la pandemia. El gobierno de Modi ya estaba exportando la vacuna para ganar favores en una lucha geopolítica con China, que ha utilizado sus grandes proyectos de infraestructura para reforzar su imagen, interpretó The New York Times. En marzo, Modi recibió la primera de las dos dosis de la vacuna. Para mediados de octubre, más de 110 millones de dosis habían sido administradas, lo que convirtió a Covaxin en la segunda vacuna contra el COVID-19 más usada en India después de la de AstraZeneca.
La OMS dijo en un tuit que Covaxin cumplía con los estándares de protección contra COVID-19 y que el beneficio de la vacuna superaba con creces los riesgos. El organismo dijo que ese desarrollo tiene una tasa de eficacia del 78 por ciento contra el COVID-19 y debe administrarse en dos dosis con cuatro semanas de diferencia en los adultos, y señaló que los requisitos de almacenamiento son más sencillos que los necesarios para otras vacunas por lo que podría ser convenientes para los países pobres y en desarrollo.
Debido a la escasez de vacunas en el mundo y la limitación que tenía India para acceder a ellas, Covaxin había sido aprobada por la agencia reguladora de medicamentos de India en enero pasado tras constatar un 81% de eficacia en los estudios clínicos. Esto fue meses antes de completarse las extensas pruebas en personas, lo que generó preocupaciones de expertos en salud de que la vacuna había sido aprobada prematuramente. Recién en julio pasado, el laboratorio Bharat Biotech publicó resultados que demostraban que la vacuna tenía una efectividad del 93% para prevenir casos severos de COVID-19 y aproximadamente 65% con la más contagiosa variante Delta.
Un grupo de expertos convocado por la OMS indicó que no hay por el momento suficientes datos sobre la inocuidad y eficiencia de la vacuna en embarazadas. Se planean estudios para abordar esas cuestiones. Tampoco hizo ninguna recomendación para el uso de Covaxin en niños.
El miércoles último, la principal autoridad reguladora de medicamentos de la India dijo que estaba extendiendo la vida útil de Covaxin de 6 a 12 meses a partir de la fecha de fabricación, según los datos que muestran que esto es seguro y efectivo.
Modi, quien recibió su primera inyección de la vacuna en marzo, dijo en la cumbre del Grupo de los 20 en Roma la semana pasada que su país podrá producir más de 5.000 millones de dosis de vacunas en general el próximo año para ayudar al mundo en la lucha contra la pandemia.
Covaxin se fabrica en tres lugares diferentes de la India, con una producción actual de más de 50 millones de dosis al mes. La compañía ha dicho que tiene como objetivo producir mil millones de dosis para fines de este año.
La aprobación de la OMS se produce después de un largo período de revisión, los fabricantes solicitaron en abril y proporcionaron el primer lote de datos a la agencia el 6 de julio, abordando una serie de problemas, incluida la seguridad y eficacia de la vacuna.
Los fabricantes de Covaxin dijeron en un comunicado el miércoles que la validación de la OMS ayudaría a acelerar las solicitudes de los países que buscan comprar la vacuna.
El 4 de junio último, el gobierno de la provincia de Buenos Aires anunció que firmó un acuerdo de aprovisionamiento para adquirir hasta 10 millones de vacunas Covaxin del laboratorio indio Bharat Biotech, extensible a 5 millones de dosis más. “Es un contrato condicionado y complementario a los nacionales, sujeto a la aprobación de ANMAT de una vacuna que ya está en Fase III y a que se eliminen las restricciones a las exportaciones en la India”, según detallaron el gobernador Axel Kicillof y Carlos Bianco, por entonces jefe de Gabinete de la administración bonaerense.
El doctor Krishna Ella, un alto funcionario de Bharat Biotech, dijo que la organización se ha centrado en mantener estrictos estándares de calidad y seguridad. La autorización de la OMS “nos permitirá contribuir a acelerar el acceso equitativo de la vacuna COVID-19 y el acceso a nuestra vacuna a nivel mundial”, dijo.
En todo el mundo, alrededor del 75 por ciento de todas las vacunas de COVID-19 se han administrado en países de ingresos altos y medianos altos, según el proyecto Our World in Data de la Universidad de Oxford. Solo el 0,6 por ciento de las dosis se han administrado en países de bajos ingresos.
Hasta el miércoles, Covaxin no era una vacuna aprobada por la OMS y quienes la habían recibido, mayoritariamente en India, debían cumplir con cuarentenas cuando viajaban al extranjero además de presentar resultados negativos de la prueba de RT-PCR o debían vacunarse con un inoculante aprobado por el país de destino.
La vacuna india se fabrica con un coronavirus muerto para provocar una respuesta inmune. “Esta es una vacuna a virus inactivados, que se administra en 2 dosis con al menos 14 días de diferencia cada una. Mostró buenas tasas de eficacia y seguridad en los estudios de Fase III. Hasta donde tengo entendido, aún no cuenta con la aprobación de ANMAT, aunque estimo que eso llegará rápido, a raíz de la aprobación de la OMS”, explicó a Infobae el infectólogo Lautaro de Vedia, ex presidente de la Sociedad Argentina de Infectología.
“Siempre suma tener vacunas, cuanto más haya, mejor, así nos cubrimos ante cualquier eventualidad, y tenemos alternativas para los diferentes tipos de pacientes”, expresó el especialista, dando a entender la importancia de contar con una nueva arma para derrotar la actual pandemia.
“El anuncio de este uso de emergencia expande la disponibilidad de las vacunas, las herramientas médicas más efectivas para acabar con la pandemia’', dijo la doctora Mariângela Simão, asistente del director general de la OMS para acceso a medicamentos y productos de salud, el miércoles, cuando el organismo anunció su aprobación para el uso de emergencia.
La vacuna es un desarrollo del laboratorio indio Bharat Biotech en sociedad con el Consejo de Investigación Médica de India, el organismo de investigación del gobierno de ese país. Se trata de la primera desarrollada y fabricada por el país asiático. Las otras vacunas que cuentan con la aprobación de la OMS son Pfizer-BioNTech, Moderna, Johnson & Johnson, Oxford/AstraZeneca (y su versión india, Covishield), Sinovac y Sinopharm.
Esta aprobación fue celebrada por el primer ministro indio, Narendra Modi, quien enfatizó su intención de hacer que su país sea autosuficiente en la lucha contra la pandemia. El gobierno de Modi ya estaba exportando la vacuna para ganar favores en una lucha geopolítica con China, que ha utilizado sus grandes proyectos de infraestructura para reforzar su imagen, interpretó The New York Times. En marzo, Modi recibió la primera de las dos dosis de la vacuna. Para mediados de octubre, más de 110 millones de dosis habían sido administradas, lo que convirtió a Covaxin en la segunda vacuna contra el COVID-19 más usada en India después de la de AstraZeneca.
La OMS dijo en un tuit que Covaxin cumplía con los estándares de protección contra COVID-19 y que el beneficio de la vacuna superaba con creces los riesgos. El organismo dijo que ese desarrollo tiene una tasa de eficacia del 78 por ciento contra el COVID-19 y debe administrarse en dos dosis con cuatro semanas de diferencia en los adultos, y señaló que los requisitos de almacenamiento son más sencillos que los necesarios para otras vacunas por lo que podría ser convenientes para los países pobres y en desarrollo.
Debido a la escasez de vacunas en el mundo y la limitación que tenía India para acceder a ellas, Covaxin había sido aprobada por la agencia reguladora de medicamentos de India en enero pasado tras constatar un 81% de eficacia en los estudios clínicos. Esto fue meses antes de completarse las extensas pruebas en personas, lo que generó preocupaciones de expertos en salud de que la vacuna había sido aprobada prematuramente. Recién en julio pasado, el laboratorio Bharat Biotech publicó resultados que demostraban que la vacuna tenía una efectividad del 93% para prevenir casos severos de COVID-19 y aproximadamente 65% con la más contagiosa variante Delta.
Un grupo de expertos convocado por la OMS indicó que no hay por el momento suficientes datos sobre la inocuidad y eficiencia de la vacuna en embarazadas. Se planean estudios para abordar esas cuestiones. Tampoco hizo ninguna recomendación para el uso de Covaxin en niños.
El miércoles último, la principal autoridad reguladora de medicamentos de la India dijo que estaba extendiendo la vida útil de Covaxin de 6 a 12 meses a partir de la fecha de fabricación, según los datos que muestran que esto es seguro y efectivo.
Modi, quien recibió su primera inyección de la vacuna en marzo, dijo en la cumbre del Grupo de los 20 en Roma la semana pasada que su país podrá producir más de 5.000 millones de dosis de vacunas en general el próximo año para ayudar al mundo en la lucha contra la pandemia.
Covaxin se fabrica en tres lugares diferentes de la India, con una producción actual de más de 50 millones de dosis al mes. La compañía ha dicho que tiene como objetivo producir mil millones de dosis para fines de este año.
La aprobación de la OMS se produce después de un largo período de revisión, los fabricantes solicitaron en abril y proporcionaron el primer lote de datos a la agencia el 6 de julio, abordando una serie de problemas, incluida la seguridad y eficacia de la vacuna.
Los fabricantes de Covaxin dijeron en un comunicado el miércoles que la validación de la OMS ayudaría a acelerar las solicitudes de los países que buscan comprar la vacuna.
El 4 de junio último, el gobierno de la provincia de Buenos Aires anunció que firmó un acuerdo de aprovisionamiento para adquirir hasta 10 millones de vacunas Covaxin del laboratorio indio Bharat Biotech, extensible a 5 millones de dosis más. “Es un contrato condicionado y complementario a los nacionales, sujeto a la aprobación de ANMAT de una vacuna que ya está en Fase III y a que se eliminen las restricciones a las exportaciones en la India”, según detallaron el gobernador Axel Kicillof y Carlos Bianco, por entonces jefe de Gabinete de la administración bonaerense.
El doctor Krishna Ella, un alto funcionario de Bharat Biotech, dijo que la organización se ha centrado en mantener estrictos estándares de calidad y seguridad. La autorización de la OMS “nos permitirá contribuir a acelerar el acceso equitativo de la vacuna COVID-19 y el acceso a nuestra vacuna a nivel mundial”, dijo.
En todo el mundo, alrededor del 75 por ciento de todas las vacunas de COVID-19 se han administrado en países de ingresos altos y medianos altos, según el proyecto Our World in Data de la Universidad de Oxford. Solo el 0,6 por ciento de las dosis se han administrado en países de bajos ingresos.
Hasta el miércoles, Covaxin no era una vacuna aprobada por la OMS y quienes la habían recibido, mayoritariamente en India, debían cumplir con cuarentenas cuando viajaban al extranjero además de presentar resultados negativos de la prueba de RT-PCR o debían vacunarse con un inoculante aprobado por el país de destino.
La vacuna india se fabrica con un coronavirus muerto para provocar una respuesta inmune. “Esta es una vacuna a virus inactivados, que se administra en 2 dosis con al menos 14 días de diferencia cada una. Mostró buenas tasas de eficacia y seguridad en los estudios de Fase III. Hasta donde tengo entendido, aún no cuenta con la aprobación de ANMAT, aunque estimo que eso llegará rápido, a raíz de la aprobación de la OMS”, explicó a Infobae el infectólogo Lautaro de Vedia, ex presidente de la Sociedad Argentina de Infectología.
“Siempre suma tener vacunas, cuanto más haya, mejor, así nos cubrimos ante cualquier eventualidad, y tenemos alternativas para los diferentes tipos de pacientes”, expresó el especialista, dando a entender la importancia de contar con una nueva arma para derrotar la actual pandemia.
“El anuncio de este uso de emergencia expande la disponibilidad de las vacunas, las herramientas médicas más efectivas para acabar con la pandemia’', dijo la doctora Mariângela Simão, asistente del director general de la OMS para acceso a medicamentos y productos de salud, el miércoles, cuando el organismo anunció su aprobación para el uso de emergencia.
Con información de
Infobae